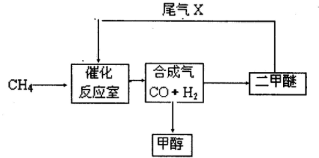
合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途. 可以生产被称为21世纪的新型燃料--甲醇、二甲醚(CH3OCH3)等物质.其工艺流程如下:
(1)写出用合成气生产二甲醚的化学方程式______.
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式______.
(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3(g)+H2O(g)△H2
①下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②已和:CH3OH(g)+
O2(g)═CO2(g)+2H2(g)△H3=-192.9kJ•mol-11 2
H2(g)+
O2(g)═H2O(g)△H4=-241.8kJ•mol-11 2
则△H2=______.
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池.写出该电池负极的电极反应式______.
(1)一氧化碳和氢气在一定的条件下合成甲醇的化学方程式为:2CO+4H2
CH3OCH3+H2O,故答案为:2CO+4H2 一定条件 .
CH3OCH3+H2O; 一定条件 .
(2)反应的平衡常数表达式=
,即表达式:K=各个生成物平衡浓度系数次方的乘积 各个反应物平衡浓度系数次方的乘积
,故答案为:K=c(CO)•c3(H2) c(H2O)•c(CH4)
;c(CO)•c3(H2) c(H2O)•c(CH4)
(3)①根据表中数据可以看出:温度越高,化学平衡常数越小,而对于放热反应,该结论成立,故答案为:<;
②根据盖斯定律来计算化学反应的焓变得出△H2=-48.9kJ•mol-1,故答案为:-48.9kJ•mol-1;
(4)燃料电池中,负极上是燃料甲醚发生失电子的氧化反应,在碱性环境下,即为:CH3OCH3+160H--12e-═2CO32-+11H2O,故答案为:CH3OCH3+160H--12e-═2CO32-+11H2O.