工业上“固定”和利用CO2能有效地减轻“温室效应”.
(1)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=______kJ•mol-1
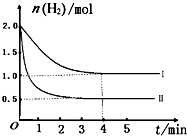
(2)T℃时,已知反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H<0.在T℃下,将2mol CO2和2mol H2充入1L的密闭容器中,测得H2的物质的量随时间的变化情况如图中曲线I所示.
①按曲线I计算反应从0到4min时,υ(H2)=______.
②在T℃时,若仅改变某一外界条件时,测得H2的物质的量随时间的变化情况如图中曲线Ⅱ所示,则改变的外界条件为______.计算该反应按曲线II进行,达到平衡时,容器中c(CO2)=______.
(3)已知25℃时,乙酸和碳酸的电离平衡常数如下表:
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
②在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中
=______.c(CH3COO-) c(CH3COOH)
③向0.1mol•L -1CH3COOH溶液中加入少量CH3COONa晶体,保持温度不变,下列有关说法正确的是______(填代号).
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)•c(H+)不变.
(1)已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
根据目标方程式,改写方程式①和②,把方程式①反写乘以2,再把方程②反写,然后二者相加,即得到目标方程,所以△H=-△H1×2-△H2=+1275.68kJ/mol,
故答案为:+1275.68;
(2)①△n=2.0-1.0=1.0mol△c=
=1mol/L v=△n V
=△c t
=0.25mol/(L•min),故答案为:0.25mol/(L•min);1mol/L 4
②根据到达平衡的时间减少,氢气也减少,平衡正移,说明增大二氧化碳的浓度,故答案为:增大二氧化碳的浓度;
(3)①根据盐类水解规律,已知CH3COONH4溶液pH=7,又因为H2CO3酸性比CH3COOH弱,水解程度更大,所以 NH4HCO3显碱性,故答案为:碱性;
②根据PH可知c(H+)=10-6mol/L和醋酸的电离常数Ka=
=1.8×10-5计算出中c(CH3COO-)•c(H+) c(CH3COOH)
=18,故答案为:18;c(CH3COO-) c(CH3COOH)
③根据影响电离平衡的因素:CH3COOH⇌CH3COO-+H+,加入少量CH3COONa晶体,
a、平衡逆移,氢离子浓度减小PH增大,故a正确;
b、平衡逆移,CH3COOH的电离程度减小,故b错误;
c、CH3COONa晶体为强电解质,溶液中带电离子浓度增大,导电能力增强,故c错误;
d、由于温度没变,所以溶液中c(OH-)•c(H+)不变,故d正确.
故答案为:ad.
