问题
计算题
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
答案
(1)反应未达到平衡, 平衡正方向移动 (2分)
(2)50% (3分) (3)75% (3分)
题目分析:
CO(g) + H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始 2 2 0 0
转化 0.5 0.5 0.5 0.5
平衡量 1.5 1.5 0.5 0.5
Q=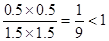 所以未达到平衡。
所以未达到平衡。
(2)平衡时CO的物质的量浓度为1mol/L,所以转化率为50%。
(3)CO(g) + H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始 2 6 0 0
转化 x x x x
平衡量 2-x 6-x x x
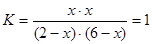 可知x=1.5 则平衡时CO的转化率为75%。
可知x=1.5 则平衡时CO的转化率为75%。
