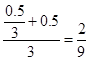在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
(1)达到平衡时CO2的物质的量分数和该反应的化学平衡常数;
(2)达到平衡后向该平衡体系中通入1.0mol水蒸气,达到新的平衡状态时,求水蒸气的物质的量和CO2的物质的量分数。
(1)25% 1
(2)1.33mol 22.22%
题目分析: CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
起始物质的量: 1.0mol 1.0mol 0 0
转化: x x x x
平衡物质的量: (1-x)mol (1-x)mol x x
依题意可知: x=0.5mol
达到平衡时CO2的物质的量分数为:x/2=0.25=25%
该反应的化学平衡常数: 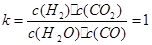
⑵ CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
平衡时各物质的浓度: 0.5mol 0.5mol 0.5mol 0.5mol
通入1.0mol水蒸气: 0.5mol 1.5mol 0.5mol 0.5mol
转化: y y y y
再次平衡: (0.5-y) (1.5-y) (0.5+y) (0.5+y)
依据平衡常数有: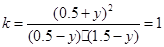
解之得: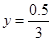
水蒸气的物质的量:n(H2O)=1.5-0.5/3=4/3mol
CO2的物质的量分数: