问题
选择题
已知N2(g)+3H2(g)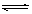 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ
B.H2的百分含量相同
C.N2的转化率:平衡I<平衡Ⅱ
D.反应放出的热量:QⅠ=QⅡ<92.3kJ
答案
答案:B
题目分析:在两个不同的容器中进行的同一个可逆反应对于第二种情况,可以认为0.2molNH3不是加入的是消耗反应物生成的。等效转化回去。根据方程式可知生成0.2molNH3消耗N20.1mol, H20.3mol.则相当于开始加入各种物质的量为1molN2和3molH20 molNH3这就是容器Ⅰ投料方式。起始状态相同,则到达化学平衡时状态也相同。平衡时各组分的含量相同及反应物的转化率等等也都一样。所以A、C、D错误。B正确。
