某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)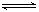 2NH3(g)+CO2(g) △H =" a" kJ/mol
2NH3(g)+CO2(g) △H =" a" kJ/mol
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①取一定量的氨基甲酸铵固体放在一个100L的密闭真空容器中,在25.0 ℃达到分解平衡。则反应 热(填“吸”或“放”) kJ/mol(用含a字母表示)。若将温度降到15.0 ℃,再次达平衡后氨基甲酸铵固体改变 g
②根据表中数据,列式计算25.0 ℃时的分解平衡常数: .
①吸 0.16a 6.24
②K=c2(NH3)·c(CO2)=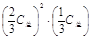 ≈1.6×10-8 (mol·L-1)3(没单位扣1分)
≈1.6×10-8 (mol·L-1)3(没单位扣1分)
题目分析:①由表中数据分析:随着温度的升高平衡气体的总浓度逐渐增大,结合反应的特点:正反应是气体物质的量增大的反应,说明平衡向正反应方向移动,结合温度对化学平衡的影响规律可得该反应为吸热反应;25.0 ℃达到分解平衡,平衡气体总浓度为4.8×10-3 mol·L-1,容器的体积100L,平衡气体的总物质的量为0.48mol,根据NH2COONH4(s) 2NH3(g)+CO2(g) △H =" a" kJ/mol该热化学方程式的意义知吸热0.16a kJ/mol;若将温度降到15.0 ℃,由表中数据知平衡气体的总物质的量由0.48mol变为0.24mol,平衡左移生成固体NH2COONH40.08mol,质量为6.24g;②根据反应:NH2COONH4(s)
2NH3(g)+CO2(g) △H =" a" kJ/mol该热化学方程式的意义知吸热0.16a kJ/mol;若将温度降到15.0 ℃,由表中数据知平衡气体的总物质的量由0.48mol变为0.24mol,平衡左移生成固体NH2COONH40.08mol,质量为6.24g;②根据反应:NH2COONH4(s) 2NH3(g)+CO2(g),n(NH3)=2n(CO2),所以(CO2)=1.6×10-3mol•L-1,c(NH3)=3.2×10-3mol•L-1,依据平衡常数的表达式K=c2(NH3)·c(CO2),25.0℃时氨基甲酸铵的分解平衡常数为:1.6×10-3mol•L-1×(3.2×10-3mol•L-1)2≈1.6×10-8(mol•L-1)3,答案为:K=c2(NH3)·c(CO2)=
2NH3(g)+CO2(g),n(NH3)=2n(CO2),所以(CO2)=1.6×10-3mol•L-1,c(NH3)=3.2×10-3mol•L-1,依据平衡常数的表达式K=c2(NH3)·c(CO2),25.0℃时氨基甲酸铵的分解平衡常数为:1.6×10-3mol•L-1×(3.2×10-3mol•L-1)2≈1.6×10-8(mol•L-1)3,答案为:K=c2(NH3)·c(CO2)=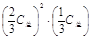 ≈1.6×10-8 (mol·L-1)3,
≈1.6×10-8 (mol·L-1)3,
