为减少污染,常将煤转化为清洁气体燃料,可将焦炭与水蒸气反应转化为氢气和一氧化碳:C(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g) 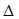 H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
(1)用H2O(g)表示反应开始到达到平衡的平均速率 ;
(2)计算T℃下该反应的平衡常数K= ;若温度升高,则反应平衡常数将 (填“增大”“减小”或“不变”)。
(3)上述条件下该反应达到平衡状态,下列说法正确的是
A.缩小容器体积,平衡向左移动
B.加入催化剂,CO的产率增大
C.增加碳的量,H2O(g)的转化率增大
D.降低温度,H2O(g)的转化率降低(4)若将上述容器改为恒压容器(两个反应器初始容积相同),相同温度下加入2molC(s)和2mol H2O(g),达到平衡后,H2O(g)的转化率将 (填“增大”“减小”或“不变”)。
(1)0.0125mol/(L•S)(2)0.225或9/40 增大(3)AD (4) 增大
题目分析:(1)根据化学反应速率的计算公式v=△c/△t,代入数据计算v(H2)=0.0125mol/(L•S),根据化学反应速率之比等于化学计量数之比得v(H2O)=0.0125mol/(L•S);
(2)利用化学平衡计算的思路——三行式来解。
C(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g)
起始浓度(mol·L-1) 1 0 0
转化浓度(mol·L-1) 0.375 0.375 0.375
平衡浓度(mol·L-1) 0.625 0.375 0.375
根据K=[H2][CO]/[H2O],将各物质的平衡浓度代入计算得K=0.225,该反应为吸热反应,升温平衡向正向移动,K增大;
(3)A、缩小容器体积,相当于增大压强,平衡向左移动,正确;B、加入催化剂,平衡不移动,CO的产率不变,错误;C、增加固体碳的量,平衡不移动,H2O(g)的转化率不变,错误;D、降低温度,该反应为吸热反应,平衡逆向移动,H2O(g)的转化率降低 ,正确。
(4)若将上述容器改为恒压容器(两个反应器初始容积相同),相同温度下加入2molC(s)和2mol H2O(g),正反应为气体物质的量增大的反应,要维持压强不变,容器体积必须增大,增大体积相当于减小压强,平衡向正向移动,达到平衡后,H2O(g)的转化率将增大。
