工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
(1)该反应的化学平衡常数表达式为 ;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是 (填字母序号) 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3)一定条件下,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号).
a.c ( H2 )减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡c ( H2 )/ c (CH3OH )减小
(4) 在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P)的关系如图所示。
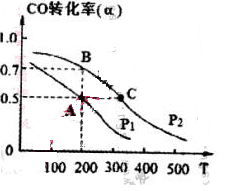
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA tC(填“大于”、“小于’’或“等于")。
②若A点时容器的体积为1 L,该温度下B点的平衡常数 K= 。
(1)[CH3OH] / [ CO][H2]2 (2)d (3)cd (4)①大于 ② 1 L2·mol-2
题目分析:结合方程式不难得知有利于增大反应的速率且提高转化率的方法为增大体系压强;(3)将容器的容积压缩会导致平衡正向移动,所以c、d正确;(4)因为C点的温度高,所以反应速率快;根据A点时CO的转化率,结合平衡常数表达式计算K=1 L2·mol-2,而B点与A点同温度,所以K相同。
