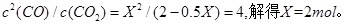一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应: C(s)+CO2(g)  2CO(g) △H>0
2CO(g) △H>0
测得容器中CO2的物质的量随时间t的变化关系如图所示。
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”) 温度下有利于该反应自发进行。
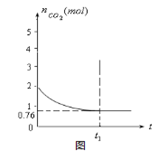
(2)列式并计算上述温度下此反应的平衡常数K 。(结果保留一位小数)
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填增大、减小、不变、无法确定)。
(4)相同温度下,2L的恒容容器丙中加入4moL碳、4moLCO2和4moLCO。开始反应时v(正) v(逆)(填>、 <、﹦)。
(5)相同温度下,2L的恒容容器乙中加入4moL碳和4moLCO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
(1)> 较高(2分,各1分)
(2)K=c2(CO)/c(CO2)=1.242/0.38="4.0" (3分)
(3)减少(2分)
(4) >(2分)
(5)如图 (3分)

题目分析:(1)生成物中气体的化学计量数之和大于反应物中气体的化学计量数之和;该反应为吸热反应;
(2)平衡常数是指可逆化学反应达到平衡时,每个产物浓度系数次幂的连乘积与每个反应物浓度系数次幂的连乘积之比;
(3)通入二氧化碳使其浓度增大,平衡向右移动,但其的转化率降低;
(4)因为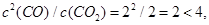 所以平衡向右移动,正反应速率大于逆反应速率;
所以平衡向右移动,正反应速率大于逆反应速率;
(5)因为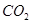 的浓度增大,所以反应速率加快,达到平衡的时间减少,设消耗Xmol
的浓度增大,所以反应速率加快,达到平衡的时间减少,设消耗Xmol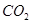 ,则有
,则有