高炉炼铁过程中发生的主要反应为1/3Fe2O3(s) + CO(g) 2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=" _________" 、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量
B.增加Fe203的量
C.移出部分CO2
D.提高反应温度E.减小容器的容积
F.加入合适的催化剂
⑴ K=c(CO2)/c(CO) < ⑵ 0.006mol/(L·min) 60℅ ⑶ C
题目分析:(1)根据化学平衡常数的定义可知:K=c(CO2)/c(CO)。由于温度升高化学平衡常数。说明升高温度,平衡向逆反应方向移动。逆反应是吸热反应,该反应的正反应为放热反应 △H<0;
(2) 1/3Fe2O3(s) + CO(g)  2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
起: 1 mol 1 mol 1 mol 1 mol
变: 1/3x x 2/3x x
终: 1 mol- 1/3x 1 mol- x 1 mol+ 2/3x 1 mol+ x
平衡常数只与温度有关,且已知1000℃时 K=4.0
即:K=c(CO2)/c(CO)=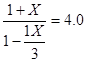 解得:x = 0.6 mol 则υ(CO2)= 0.6 mol/ (10L·l0 min) = 0.006 mol/ (L·min)
解得:x = 0.6 mol 则υ(CO2)= 0.6 mol/ (10L·l0 min) = 0.006 mol/ (L·min)
CO的平衡转化率= 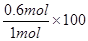 ℅ = 60℅
℅ = 60℅
(3)因Fe和Fe2O3为固体,对平衡没有影响所以A、B错误;C中CO2为气体生成物,减少生成物浓度平衡向正反应方向移动,故C正确;升高温度平衡向吸热反应方向移动。对于该反应来说是向逆反应方向移动,CO的平衡转化率降低。D错误;因为该反应是前后气体相等的可逆反应。所以减小容器的容积也就是增大压强。化学平衡不发生移动。CO的平衡转化率不变。E错误;催化剂只改变化学反应速率而不影响平衡的移动,故F错误。
