请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1∶2
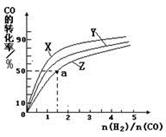
D.单位时间内,消耗2molH2的同时消耗1mol CH3OH②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是 ;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K(写出计算过程)。
(2)已知: CO(g)+ 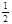 O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+ 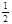 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为 __________
(1)①AD(2分,漏选得1分,错选得0分)
②270℃(2分,无单位或单位错扣1分),
(2)CH3OH(g)+3/2O2(g) CO2(g)+2H2O(g) △H=-651kJ·mol-1 (2分)
CO2(g)+2H2O(g) △H=-651kJ·mol-1 (2分)
题目分析:(1)①A选项因反应前后气体的量发生改变,压强不变,可以说明到达平衡。D选项满足V正=V逆②因为Z图像中CO的转化率最低,所以对应的温度最高。270℃ 。根据图像可知a点对应的CO的转化率为50%,H2的物质的量为1.5 mol
CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
起始物质的量浓度(mol/L) 1 1.5 0
转化物质的量浓度(mol/L) 0.5 1 0.5
平衡物质的量浓度(mol/L) 0.5 0.5 0.5
K=4
(2)利用盖斯定律可以写出CH3OH(g)+3/2O2(g) CO2(g)+2H2O(g) △H=—△H1+△H2+2△H3
CO2(g)+2H2O(g) △H=—△H1+△H2+2△H3
