实验是化学的基础.某学习小组设计并进行了下述两个实验.
(1)探究KI溶液和FeCl3溶液反应存在一定的限度.
可选试剂:①0.1mol•L-1KI溶液 ②0.1mol•L-1 FeCl3溶液 ③FeCl2溶液 ④盐酸⑤KSCN溶液 ⑥CCl4
实验步骤:
①取5mL 0.1mol•L-1 KI溶液,滴加5~6滴0.1mol•L-1FeCl3溶液;
②充分反应后,将溶液分成两份;
③取其中一份,滴加CCl4,充分振荡,静置,CCl4层呈紫红色,说明反应生成碘.
④另取一份,滴加试剂______,现象______,说明______.
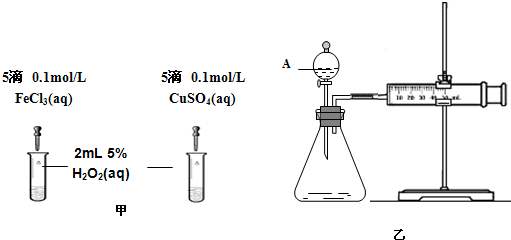
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.请回答下列问题:
①定性分析:如图甲可通过观察______,定性比较得出结论;有同学提出将CuSO4改为CuCl2更为合理,其理由是______.
②定量分析:如图乙所示,实验时均以生成40mL气体为准,实验中需要测量的数据是______.
(1)④可以用KSCN溶液(即⑤),来检验三价铁是否剩余,若果溶液显红色,说明三价铁剩余,KI溶液和FeCl3溶液反应不彻底,反之则进行彻底,故答案为:KSCN溶液(即⑤);溶液显红色;溶液中还有Fe3+
(2)①可以通过观察产生气泡的快慢来定性比较比较Fe3+和Cu2+对H2O2分解的催化效果,将CuSO4改为CuCl2更为合理,这样Fe3+和Cu2+中的阴离子种类相同,可以排除因阴离子的不同可能带来的影响,故答案为:产生气泡的快慢;排除因阴离子的不同可能带来的影响;
②均以生成40mL气体为准时,产生等量的气体用的时间越短,则反应速率越快,所以实验中需要测量的数据是收集40mL气体所需的时间,故答案为:收集40mL气体所需的时间.
