某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O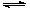 CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH="12.3" [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O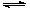 HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体, 减小
减小
d.稀释溶液,平衡常数增大
(1)
(2)碱性条件下CO2与Ca2+生成难溶物CaCO3
(3)不与Ca2+生成难溶物 酸性比碳酸弱
(4)酸性物质与OH-反应,使平衡向生成CaSO4·2H2O的方向进行 SO42-+ Ca(OH)2+2HA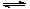 CaSO4·2H2O↓+2A- (每空2分)
CaSO4·2H2O↓+2A- (每空2分)
(5)(2分)a d
题目分析:(1)根据平衡常数表达式,该反应的平衡常数表达式K=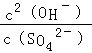 ;
;
(2)①在碱性条件下CO2与Ca2+生成难溶物CaCO3,所以不直接通入CO2;
(3)加入酸性物质,氢离子可以中和氢氧根离子,使平衡向着生成CaSO4•2H2O的方向进行;以HA表示所添加的酸性物质,由于HA酸性要小于碳酸酸性,反正方程式中应该写成分子式,所以总反应的离子方程式为SO42﹣+Ca(OH)2+2HA⇌CaSO4•2H2O↓+2A﹣;
(5)a.加水稀释,平衡右移溶液中CO32-,HCO3-,OH-离子的浓度都减小,但氢离子浓度增大,错误;b.通入CO2,溶液酸性增加,pH减小,正确;c.加入NaOH固体,平衡左移, 减小,正确;d.稀释溶液,平衡常数不变,错误;
减小,正确;d.稀释溶液,平衡常数不变,错误;
