在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(2)用水稀释0.1 mol·L-1氨水(设稀释时溶液温度不变),则溶液中随着水量的增加而减小的是下列的 (填序号):
A.c(NH3·H2O) B.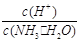 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.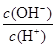
(3)工业用氨制取硝酸的氧化反应为:4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
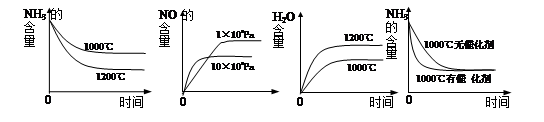
A B C D
(4)在1L容积固定的密闭容器中发生上述反应,部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
反应在第6 min到8min时改变了条件,改变的条件可能是___________________;在该条件下,平衡向_______移动(填“左”或“右”)。
(1)(1分) > (2)(2分) AD (3)(2分)BD
(4)(3分)升高温度(或增大压强,2分) 左 (1分)
题目分析:(1)从表中可以看出,随着温度的升高,平衡常数越来越大,说明反应正向进行,依据平衡移动原理,可知正向是吸热的方向,也就是说a>0 ;(2)加水稀释,这个平衡中所涉及到的所有的物质的浓度都减小,尽管平衡正向移动,但浓度减小是主要的,移动只是减弱这种改变,但不能消除,因此选AD。 (3)A、升高温度,平衡逆向移动,氨的含量增加,错误;B、正确;C、升高温度,平衡逆向移动,水的含量减小,错误;D、正确。
