化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
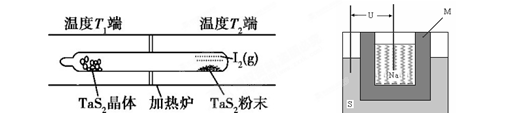
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
(1)80%(2分)(2)>(1分); I2(2分)(3)xS+2e-=Sx2-(2分);离子导电(2分)
(4)S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-(2分,只写第一步也可得分)
H2S+OH-(2分,只写第一步也可得分)
c(HS-)+2c(S2-)+c(OH-) (2分)
题目分析:(1) TaS2(s)+2I2(g) TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始量(mol) 1 0 0
转化量(mol) 2x x x
平衡量(mol) 1-2x x x
由于反应前后体积不变,因此可以用物质的量代替物质的量浓度表示其平衡常数,即
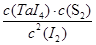 =4=
=4=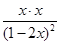
解得x=0.4
所以I2(g)的平衡转化率为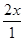 ×100%=80%
×100%=80%
(2)加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,这说明低温有利于TaS2晶体的生成,因此逆反应是放热反应,则正方应是吸热反应,即△H>0;先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),而最后又产生单质碘,因此单质碘是可以循环的物质。
(3)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式2Na + xS=Na2Sx可知,钠是还原剂,做负极,S单质是氧化剂,在正极得到电子,因此正极反应式为xS+2e-=Sx2-。在熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,因此另外一种作用是离子导电。
(4)硫化钠是强碱弱酸盐,S2-水解溶液显碱性,因此Na2S溶液水解的离子方程式为S2-+H2O HS-+OH-、HS-+H2O
HS-+OH-、HS-+H2O H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
H2S+OH-;根据电荷守恒可知Na2S溶液中c(H+)+ c(Na+)=c(HS-)+2c(S2-)+c(OH-)。
