问题
填空题
某学生两次分别用2.6 g锌与硝酸溶液进行反应,两次所用的硝酸溶液中均含有6.3 g的HNO3,但浓度不同,均恰好完全反应。又已知第一次实验中有1/5的HNO3被还原,第二次实验中只有1/10的HNO3被还原。试写出相应的反应方程式___________________________
_______________________________________________________________________________。
答案
4Zn+10HNO3====4Zn(NO3)2+N2O↑+5H2O
4Zn+10HNO3====4Zn(NO3)2+NH4NO3+3H2O
2.6 g Zn为0.04 mol,6.3 g HNO3为0.1 mol。第一次实验:
0.04 mol×2=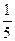 ×0.1 mol×(5-n)
×0.1 mol×(5-n)
n=+1,即生成物为N2O。
第二次实验:
0.04 mol×2=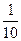 ×0.1 mol×(5-n)
×0.1 mol×(5-n)
n=-3,即还原产物为NH4NO3。
