(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值 (填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10 L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
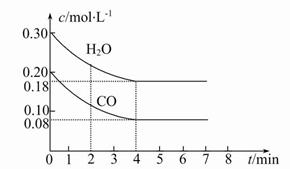
①0~4 min时间段平均反应速率v(CO)= mol·L-1·min-1。
②在800℃时该反应的化学平衡常数K= (要求写出表达式及数值),CO的转化率= 。
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol·L-1和0.80 mol·L-1,则达到平衡时CO转化为CO2的转化率是 。
(1)可能增大也可能减小
(2)①0.03 ②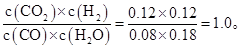 60% ③80%
60% ③80%
(1)化学平衡常数与温度有关,若正反应为吸热反应,升高温度,平衡常数增大;若正反应为放热反应,升高温度,平衡常数减小,所以温度升高,K值可能增大,也可能减小。
(2)①根据图像可知,在4 min内CO的浓度变化为0.12 mol·L-1,所以CO的反应速率为0.12 mol·L-1/4 min="0.03" mol·L-1·min-1。
②由图像可知,反应在4 min时达平衡,CO和H2O的平衡浓度分别为
0.08 mol·L-1、0.18 mol·L-1,CO2和H2的浓度分别为0.12 mol·L-1、
0.12 mol·L-1,所以该反应的平衡常数为:K=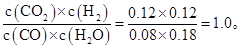
CO的转化率为0.12 mol·L-1/0.20 mol·L-1×100%=60%。
③设达到平衡时CO转化的浓度为x,则达到平衡时CO、H2O、CO2、H2的浓度分别为0.20-x、0.80-x、x、x。所以根据平衡常数表达式x2/(0.80-x)(0.20-x)=1.0,x="0.16" mol·L-1,CO的转化率为0.16 mol·L-1/0.20 mol·L-1×100%=80%
