问题
计算题
(6分)
将1molH2和1molI2(g)加入2L密闭容器中进行反应:H2 + I2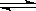 2HI,反应进行到2min时测得反应速率v(HI)=" 0.2mol" /(L·min)。求
2HI,反应进行到2min时测得反应速率v(HI)=" 0.2mol" /(L·min)。求
(1)用氢气的浓度变化来表示2min内的该反应的平均速率?
(2)2min末I2(g)的物质的量浓度?
答案
(1)0.1mol /(L·min) (2)0.3mol/L
考查可逆反应的应该计算。
(1)因为反应速率之比是相应的化学计量数之比
所以氢气的反应速率是0.2mol /(L·min)÷2=0.1mol /(L·min)
(2)消耗氢气是0.1mol /(L·min)×2min×2L=0.4mol
则同时消耗碘单质是0.4mol
所以属于单质碘是1mol-0.4mol=0.6mol
因此其浓度是0.6mol÷2L=0.3mol/L。
