(1)(福建高考)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g) H2(g)+
H2(g)+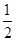 S2(g)
S2(g)
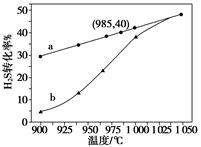
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985 ℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:__________________________。
(2)(海南高考)CuBr2分解的热化学方程式为:
2CuBr2(s) 2CuBr(s)+Br2(g) ΔH=+105.4 kJ/mol
2CuBr(s)+Br2(g) ΔH=+105.4 kJ/mol
在密闭容器中将过量CuBr2于487 K下加热分解,平衡时p(Br2)为4.66×103 Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______________(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为________________。
(1)①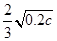 温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)
温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)
(2)①增大 ②2.33×103 Pa<p(Br2)≤4.66×103 Pa
(1)①由图知,985 ℃时H2S的平衡转化率为40%,则:
H2S(g) H2(g)+
H2(g)+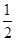 S2(g)
S2(g)
起始浓度
(mol·L-1) c 0 0
平衡浓度
(mol·L-1) 0.6c 0.4c 0.2c
则K=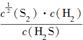 =
=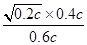 =
=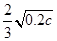
b曲线表示未达到平衡时H2S的转化率,温度越高,b曲线上的转化率越接 * * 衡值,原因是温度升高,反应速率加快,达到平衡所需的时间缩短。
(2)①升高温度,平衡向吸热反应方向移动,因而可提高p(Br2);②体积增大一倍时,p(Br2)降为原来的一半,即2.33×103 Pa,减压使平衡向气体体积数增大的方向移动,因而会大于2.33×103 Pa;若反应物足量,可平衡恢复到原有的p(Br2)。
