在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)能说明该反应达到化学平衡状态的是 (填字母)。
a.υ正(CO2)=υ正(H2) b.υ逆(CO)=υ逆(H2O)
c.υ逆(H2)=υ逆(H2O) d.υ正(H2)=υ逆(H2)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得 c(CO)="0.0080" mol·L-1,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(1)吸热 (1分)
(2)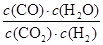
(3)d(2分)
(4)80%(2分)
(5)830(2分)
试题解析:(1)升高温度,K值增大,说明升温平衡正向移动,所以正向为吸热反应。
(2)根据平衡常数的定义可得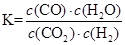
(3)当反应达到化学平衡状态时υ正=υ逆,a、b、c均代表同向的反应速率,错误,答案选d。
(4)CO2(g)+H2(g)⇌CO(g)+H2O(g)平衡后c(CO) =" 0.0080" mol·L-1,可计算出转化的c(CO2)=" 0.0080" mol·L-1,初始浓度c(CO2)="0.1mol/10L=0.01" mol·L-1,所以CO2的转化率为0.0080 mol·L-1/0.01 mol·L-1×100%=80%。
(5)根据c(CO2)·c(H2)=c(CO)·c(H2O)可知K=1.0,所以此时的温度为830℃。
