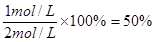问题
计算题
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经10min后反应达平衡时,测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经10min后反应达平衡时,测定该反应在该温度下的平衡常数K=1,试判断:
(1) 用H2O(g)表示该反应的反应速率?
(2)达到平衡时,CO的转化率为多少?
答案
(1)0.1mol/(L·min) (2) 50%
考查可逆反应的有关计算。
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 2 2 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L)(2-x) (2-x) x x
则根据平衡常数表达式可知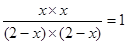
解得x=1mol/L
所以水蒸气的反应速率是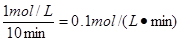
CO的转化率是