合成氨尿素工业生产过程中涉及的物质转化过程如下图所示。
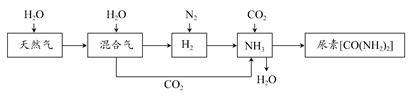
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为___________________________________。
(2)在合成氨生产中,将生成的氨气及时从反应后的气体中分离出来。运用化学平衡的知识分析这样做是否有利于氨的合成,说明理由:___________。
(3)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
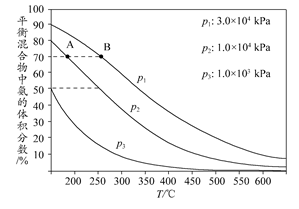
①若分别用vA(NH3)和vB(NH3)表示从反应开始至平衡状态A、B时的化学反应速率,则vA(NH3)________vB(NH3)(填“>”、“<”或“=”)。
②在相同温度下,当压强由p1变为p3时,合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
③在250°C、1.0×104kPa下,H2的转化率为________%(计算结果保留小数点后1位)。
(1)CH4+H2O(g) CO+3H2
CO+3H2
(2)移走氨气,减小生成物浓度,平衡右移,有利于氨的合成
(3)①< ②不变 ③66.7
(1)由原子守恒可写出:CH4+H2O(g) CO+3H2。(2)从反应体系中移走氨气,减小了生成物浓度,平衡向右移动,利于NH3生成。(3)化学平衡常数只和温度有关,改变压强,化学平衡常数不变。由图示可知250°C、1.0×104 kPa时,平衡混合物中NH3占50%,设N2的转化量为x,则:
CO+3H2。(2)从反应体系中移走氨气,减小了生成物浓度,平衡向右移动,利于NH3生成。(3)化学平衡常数只和温度有关,改变压强,化学平衡常数不变。由图示可知250°C、1.0×104 kPa时,平衡混合物中NH3占50%,设N2的转化量为x,则:
N2 + 3H2 2NH3
2NH3
起始: 1 3 0
转化: x 3x 2x
平衡: 1-x 3-3x 2x
即: ×100%=50%,解得x=2/3,
×100%=50%,解得x=2/3,
故a(H2)= ×100%≈66.7%。
×100%≈66.7%。
