在容积为2.0 L的密闭容器中充入0.60 mol X和1.60 mol Y,发生反应:
aX(g)+3Y(g)  2Z(g)
2Z(g)
经过10 min反应达到平衡状态,Y的浓度为0.2 mol/L,Z的物质的量分数为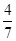 。
。
计算:① 10min内,Z的平均反应速率;
② a 的值;
③ 该条件下X的平衡转化率(百分数表示,保留一位小数);
④该条件下反应2Z(g)  aX(g)+3Y(g)的平衡常数。
aX(g)+3Y(g)的平衡常数。
①0.04mol/(L·min) ②a=1 ③66.7% ④0.005
考查可逆反应的有关计算,一般采用三段式。
aX(g) + 3Y(g)  2Z(g)
2Z(g)
起始量(mol) 0.6 1.6 0
转化率(mol) 0.4a 1.2 0.8
平衡量(mol) 0.6-0.4a 0.4 0.8
所以有(0.6-0.4a+0.4+0.8)×4/7=0.8
解得a=1
Z的反应速率是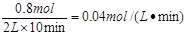
X的转化率是0.4÷0.6×100%=66.7%
平衡时XYZ的浓度分别是0.1mol/L、0.2mol/L、0.4mol/L
所以平衡常数等于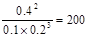
因此其逆反应的平衡常数就是0.005
