问题
选择题
下列说法正确的是:
A.已知某温度下纯水中的C(H+)=2×l0-7mol/L,据此无法求出水中C(OH-)
B.常温,Mg(OH)2能溶于氯化铵浓溶液主要原因是NH4+结合OH-使沉淀溶解平衡发生移动
C.已知:
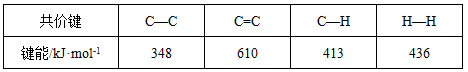
上表数据可以计算出 (g)+3H2(g)→
(g)+3H2(g)→ (g)的焓变
(g)的焓变
D.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2/L2
答案
答案:B
题目分析:A不正确,任何纯水中氢离子浓度等于OH-浓度;由于苯环中的化学键是一种介于碳碳单键和碳碳双键之间的一种独特的化学键,所以不能计算出该反应的反应热;D不正确,因为两种溶液中c(CO32-)浓度不同,所以镁离子的浓度也是不同的,所以答案选B。
点评:溶解平衡也是一种动态平衡,在判断外界条件对平衡状态的影响时,也需要借助于勒夏特例原理。另外溶度积常数也和化学平衡常数相似,在计算时可以进行类推即可。
