开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)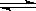 CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
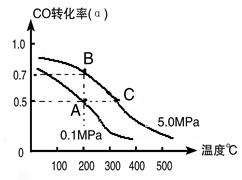
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
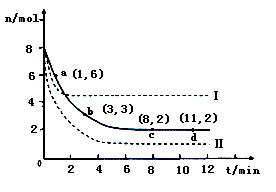
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
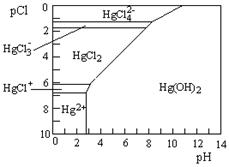
①下列说法中正确的是 。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是 (填晶体类型)。
(1)①K="0.25" (2分) ②大于(2分) ③原料易得、可以减轻温室效应等(2分)
(2)①(2分)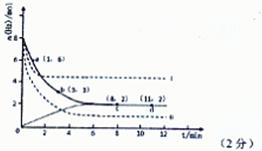
② 升温, 增压(各1分)
(3)①AD ②分子晶体
题目分析:(1)① 2CO(g)+4H2(g)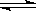 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
起始浓度(mol/L) 1 2 0 0
转化浓度(mol/L)0.5 1.0 0.25 0.25
平衡浓度(mol/L)0.5 1.0 0.25 0.25
根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该温度下反应的平衡常数K=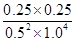 =0.25。
=0.25。
②根据图像可知,C点温度和压强均大于A点温度和压强,所以C点反应速率快,达到平衡的时间少。
③由于氮气中CO2的含量逐渐增大,所以该方法的优点是原料易得、可以减轻温室效应。
(2)①根据图像可知平衡时氢气的物质的量是2mol,消耗氢气的物质的量是8mol-2mol=6mol,所以根据方程式可知平衡时生成甲醇的物质的量是2mol,因此图像可表示为见答案。
②曲线I与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量增加,说明平衡向逆反应方向移动。由于正方应是体积减小的可逆反应,所以改变的条件只能是升高温度,即正方应是放热反应;曲线Ⅱ与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量减少,这说明平衡向正反应方向移动。由于正方应是体积减小的放热的可逆反应,所以改变的条件只能是增大压强。
(3)①A.Hg2+水解溶液显酸性,所以为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释,A正确;B.当c(C1ˉ) =10ˉ1 mol·Lˉ1即pCl=1时,汞元素主要是以HgCl42ˉ形式存在,B不正确;C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2 HgCl+ + HgCl3ˉ,C不正确;D.根据图像可知当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,D正确,答案选AD。
HgCl+ + HgCl3ˉ,C不正确;D.根据图像可知当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,D正确,答案选AD。
②HgCl2又称“升汞”,熔点549K,加热能升华,这说明晶体是分子晶体。
