已知CO2(g)+H2(g)  CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:
| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
请回答下列问题:
(1)上述正向反应是________反应(选填“放热”或“吸热”)。
(2)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
E.混合气体的密度不变
(3)在850 ℃发生上述反应,以表中的物质的量投入恒容反应器中,其中向正反应方向进行的有________(选填A、B、C、D、E)。
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(4)在850 ℃时,可逆反应:CO2(g)+H2(g)CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间 /min | CO2 (mol·L-1) | H2 (mol·L-1) | CO (mol·L-1) | H2O (mol·L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
则3 min~4 min平衡后c3=________mol·L-1,CO2的转化率为________。
(1)放热 (2)C (3)A (4)0.12 60%
(1)由表可知温度升高,K减小,说明温度升高,平衡逆向进行,正反应为放热反应。(2)因为该反应为反应前后气体分子数不变的反应,所以压强不变,平均相对分子质量不变,均不能说明达到平衡状态,A、D错;选项B中CO2和CO的浓度相等,不能说明其浓度不再变化,故B错;生成CO2代表逆反应,消耗H2代表正反应,且比值等于反应方程式中的对应化学计量数之比,选项C正确;气体的质量不变且为恒容容器,所以气体密度不变不能说明达到平衡状态。(3)计算各组的浓度商:QA=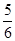 <1 QB=
<1 QB=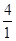 >1 QD=
>1 QD=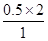 =1 QE=
=1 QE=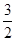 >1
>1
由浓度商QC<K,反应正向进行推断,A项向正反应方向进行。
(4)850 ℃,K=1,设CO2的转化量为x由
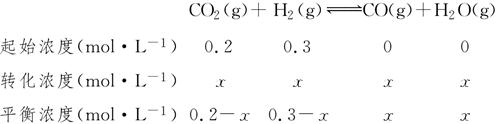
则平衡常数K=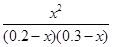 =1
=1
所以x=0.12,故c3=0.12,
α(CO2)=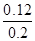 ×100%=60%。
×100%=60%。
