问题
填空题
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
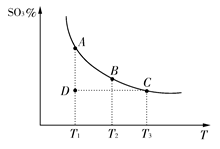
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)  2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)2SO2(g)+O2(g)  2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
2SO3(g)的ΔH________0(填“>”或“<”);若在恒温;恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不”);
(2)若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1________K2;若反应进行到状态D时,v正________v逆(填“>”“<”或“=”);
答案
(1)< 向左 (2)> >
(1)从图像来看,SO3的含量随着温度的升高而降低,说明反应逆向移动,故该反应为放热反应;恒温、恒容条件下,充入氦气,容器容积增大,对原反应混合物来说相当于减小压强,平衡逆向移动。(2)因该反应是放热反应,平衡常数随着温度的升高而降低;D点要达到相应温度下的平衡状态,SO3的含量应继续增大,故正反应速率大于逆反应速率。
