在密闭容器中进行的如下反应:2SO2(g)+O2(g) 2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
(1)反应的平衡常数为________。
(2)若将平衡时反应混合物的压强增大1倍,平衡将________(填“正向”“逆向”或“不”)移动。
(3)若平衡时反应混合物的压强减小1倍,平衡将________(填“正向”“逆向”或“不”)移动。
(4)平衡时保持体积不变,向平衡混合气体中充入稀有气体Ar,使体系总压变为原来的3倍,平衡将________(填“正向”“逆向”或“不”)移动。
(1)19.0(mol·L-1)-1
(2)正向 (3)逆向 (4)不
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度/mol·L-1 0.4 1 0
转化浓度/mol·L-1 0.4×80% 0.16 0.32
平衡浓度/mol·L-1 0.08 0.84 0.32
(1)平衡常数
K=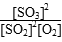 =
=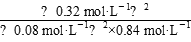
=19.0(mol·L-1)-1
(2)压强增大1倍,各组分的浓度增大1倍,
Q=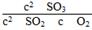 =
=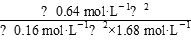 =9.5(mol·L-1)-1<19.0(mol·L-1)-1即Q<K,平衡正向移动。
=9.5(mol·L-1)-1<19.0(mol·L-1)-1即Q<K,平衡正向移动。
(3)压强减小1倍,各组分的浓度也减小1倍
Q= =
=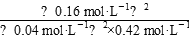 =38.1(mol·L-1)-1>19.0(mol·L-1)-1即Q>K,平衡逆向移动。
=38.1(mol·L-1)-1>19.0(mol·L-1)-1即Q>K,平衡逆向移动。
(4)保持体积不变,充入稀有气体Ar,各组分的浓度不变,平衡不移动。
