如图所示,甲、乙均为容积1L的恒容容器,丙为恒压容器。

向甲、丙中分别充入相应气体,使丙起始体积为1L,维持500℃发生反应:2SO2+O2  2SO3至平衡。
2SO3至平衡。
甲中反应10min后达到平衡时,容器中SO3的体积分数为91%,则反应从开始至平衡的平均反应速率v(O2)= mol·L-1·min-1,平衡常数表达式为 。SO2的平衡转化率= 。丙中达到平衡所需的时间 10min(填“>”、“=”、“<”),SO3的体积分数 91%(填“>”、“=”、“<”)。若上述已达平衡的甲、丙容器中分别充入0.5molAr气体,容器中SO3的物质的量:甲 丙 (填“增大”、“不变”、“减小”)。
(2)若在乙容器中充入x molSO2 0.2molO2 ymolSO3维持500℃反应至平衡时,容器中SO3的体积分数亦为91%,则x= ,y= 。
(1)0.0938 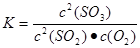 ; 93.8% < > 不变 减小;(2)x=0.4 y=1.6
; 93.8% < > 不变 减小;(2)x=0.4 y=1.6
题目分析:(1)根据反应方程式2SO2+O2  2SO3,假如氧气反应消耗xmol.则消耗SO2 2xmol. 产生SO32xmol。由于容器中SO3的体积分数为91%,所以2x÷{(1-x)+(2-2x)+2x}=91%.解得x=0.938.所以v(O2)= 0.938mol÷1L÷10min=0.0938mol/(L·min). 由方程式可知消耗SO2的量与产生的SO3相等。所以平衡时SO2转化率=(2×0.938)÷2×100%=93.8%.当反应达到平衡时的化学平衡常数为
2SO3,假如氧气反应消耗xmol.则消耗SO2 2xmol. 产生SO32xmol。由于容器中SO3的体积分数为91%,所以2x÷{(1-x)+(2-2x)+2x}=91%.解得x=0.938.所以v(O2)= 0.938mol÷1L÷10min=0.0938mol/(L·min). 由方程式可知消耗SO2的量与产生的SO3相等。所以平衡时SO2转化率=(2×0.938)÷2×100%=93.8%.当反应达到平衡时的化学平衡常数为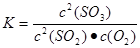 由于甲为恒容的密闭容器。随着反应的进行,体系的压强减小;而丙是恒压的密闭容器。增大压强,物质的浓度增大,化学反应速率加快,达到化学平衡所需要的时间缩短。所以达到平衡所需的时间<10min。增大压强化学平衡向气体体积减小的反应方向移动,即向正反应方向移动,所以SO3的体积分数>91%;若上述已达平衡的甲、丙容器中分别充入0.5molAr气体,甲因为容器的容积不变,所以对平衡无影响,容器中SO3的物质的量不变;而丙容器中由于是恒压,所以容器的容积扩大,各组分气体的气体分压减小,所以平衡逆向移动。因此达到平衡时SO3的物质的量减小。(2)若在乙容器中充入x molSO2 0.2molO2 ymolSO3维持500℃反应至平衡时,容器中SO3的体积分数亦为91%,可以认为ymolSO3不是加入的,而是通过反应消耗SO2 和O2产生的。根据方程式中的物质间的关系可知消耗SO2ymol;消耗O2y/2mol;则开始时加入的SO2为(x+y)mol;加入的O2为(0.2+y/2)mol.由于平衡时容器中SO3的体积分数亦为91%,所以是同一平衡状态。因此(x+y)=2;0.2+y/2=1。解得x=0.4 y=1.6。
由于甲为恒容的密闭容器。随着反应的进行,体系的压强减小;而丙是恒压的密闭容器。增大压强,物质的浓度增大,化学反应速率加快,达到化学平衡所需要的时间缩短。所以达到平衡所需的时间<10min。增大压强化学平衡向气体体积减小的反应方向移动,即向正反应方向移动,所以SO3的体积分数>91%;若上述已达平衡的甲、丙容器中分别充入0.5molAr气体,甲因为容器的容积不变,所以对平衡无影响,容器中SO3的物质的量不变;而丙容器中由于是恒压,所以容器的容积扩大,各组分气体的气体分压减小,所以平衡逆向移动。因此达到平衡时SO3的物质的量减小。(2)若在乙容器中充入x molSO2 0.2molO2 ymolSO3维持500℃反应至平衡时,容器中SO3的体积分数亦为91%,可以认为ymolSO3不是加入的,而是通过反应消耗SO2 和O2产生的。根据方程式中的物质间的关系可知消耗SO2ymol;消耗O2y/2mol;则开始时加入的SO2为(x+y)mol;加入的O2为(0.2+y/2)mol.由于平衡时容器中SO3的体积分数亦为91%,所以是同一平衡状态。因此(x+y)=2;0.2+y/2=1。解得x=0.4 y=1.6。
