煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
A.容器中的压强不变
B.1 mol H—H键断裂的同时断裂2 mol H—O键
C.v正(CO)=v逆(H2O)
D.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①该反应的逆反应为 (填“吸”或“放”)热反应。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是
CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是

A.升高温度
B.充入N2(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入0.5 mol CO2和1.5 mol H2
(1)B、C (2) ① 吸热; ②b=2a,且a>1 (3)C、D
题目分析:(1)由于反应C(s)+H2O(g)  CO(g)+H2(g)的正反应是个气体体积增大的反应。A.若反应未达到平衡,则容器中的压强会发生改变,若反应达到了平衡,则容器内气体的压强不变。正确。B.1 mol H—H键断裂就会产生1mol的水,就形成了2mol的H—O键。还同时断裂2 mol H—O键。说明对于同种物质来说,单位时间内消耗量与产生量相等。反应达到平衡。正确。D.CO和H2都是生成物,在方程式中二者的系数相同,所以在任何时候都存在c(CO)=c(H2)。故不能确定反应达到平衡。错误。所以选项为B C。(2)① 反应CO(g)+H2O(g)
CO(g)+H2(g)的正反应是个气体体积增大的反应。A.若反应未达到平衡,则容器中的压强会发生改变,若反应达到了平衡,则容器内气体的压强不变。正确。B.1 mol H—H键断裂就会产生1mol的水,就形成了2mol的H—O键。还同时断裂2 mol H—O键。说明对于同种物质来说,单位时间内消耗量与产生量相等。反应达到平衡。正确。D.CO和H2都是生成物,在方程式中二者的系数相同,所以在任何时候都存在c(CO)=c(H2)。故不能确定反应达到平衡。错误。所以选项为B C。(2)① 反应CO(g)+H2O(g)  CO2(g)+H2(g)在650℃时,开始时n(CO)=4mol;n(H2O)=2mol;n(CO2)=0;n(H2)=0.当反应达到平衡时各种物质的物质的量为n(CO)=4mol-1.6mol=2.4mol;n(H2O)=2mol-1.6mol=0.4mol,n(CO2)=1.6mol;n(H2)=1.6mol。对于该反应来说,由于系数都是1,所以达到平衡状态时的平衡常数为
CO2(g)+H2(g)在650℃时,开始时n(CO)=4mol;n(H2O)=2mol;n(CO2)=0;n(H2)=0.当反应达到平衡时各种物质的物质的量为n(CO)=4mol-1.6mol=2.4mol;n(H2O)=2mol-1.6mol=0.4mol,n(CO2)=1.6mol;n(H2)=1.6mol。对于该反应来说,由于系数都是1,所以达到平衡状态时的平衡常数为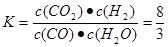 。在900℃时,开始时n(CO)=2mol;n(H2O)=1mol;n(CO2)=0;n(H2)=0.当反应达到平衡时各种物质的物质的量为n(CO)= 1.6mol;n(H2O)=1mol-0.4mol=0.6mol,n(CO2)=0.4mol;n(H2)=0.4mol。对于该反应来说,由于系数都是1,所以达到平衡状态时的浓度比为物质的量的比。所以在该温度下平衡常数为
。在900℃时,开始时n(CO)=2mol;n(H2O)=1mol;n(CO2)=0;n(H2)=0.当反应达到平衡时各种物质的物质的量为n(CO)= 1.6mol;n(H2O)=1mol-0.4mol=0.6mol,n(CO2)=0.4mol;n(H2)=0.4mol。对于该反应来说,由于系数都是1,所以达到平衡状态时的浓度比为物质的量的比。所以在该温度下平衡常数为 。升高温度,化学平衡常数减小。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,因为反应的平衡状态相同。而方程式的系数相同。所以只要反应物的物质的量的比与原平衡的起始时的物质的量的比相同。即二者的物质的量的比为a:b=1:2。平衡不发生移动。但是由于增大压强,反应物的物质的量浓度增大,化学反应速率加快,达到平衡所需要的水解缩短。(3)由图像可以看出该反应为放热反应。A.升高温度。根据平衡移动原理,化学平衡向逆反应方向移动,c(CH3OH)减小。错误。B.由于N2不是反应体系的气体,充入N2(g),使体系压强增大,但是反应混合物中各物质的浓度不变,所以平衡不发生移动,c(CH3OH)不变。错误。C. 将H2O(g)从体系中分离出来,减小生成物的浓度,平衡正向移动,c(CH3OH)增大。正确。D.若再充入0.5 mol CO2和1.5 mol H2,增大反应物的浓度,化学平衡正向移动,c(CH3OH)增大。正确。
。升高温度,化学平衡常数减小。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应。②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,因为反应的平衡状态相同。而方程式的系数相同。所以只要反应物的物质的量的比与原平衡的起始时的物质的量的比相同。即二者的物质的量的比为a:b=1:2。平衡不发生移动。但是由于增大压强,反应物的物质的量浓度增大,化学反应速率加快,达到平衡所需要的水解缩短。(3)由图像可以看出该反应为放热反应。A.升高温度。根据平衡移动原理,化学平衡向逆反应方向移动,c(CH3OH)减小。错误。B.由于N2不是反应体系的气体,充入N2(g),使体系压强增大,但是反应混合物中各物质的浓度不变,所以平衡不发生移动,c(CH3OH)不变。错误。C. 将H2O(g)从体系中分离出来,减小生成物的浓度,平衡正向移动,c(CH3OH)增大。正确。D.若再充入0.5 mol CO2和1.5 mol H2,增大反应物的浓度,化学平衡正向移动,c(CH3OH)增大。正确。
