在溶液中,反应A+2B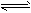 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、
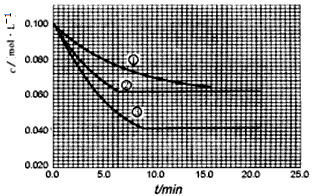
c(B) =0. 200 mol/L及c(C) =0 mol/L。反应物A的浓度随时问的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②________________;③__________________;
(2)实验②平衡时B的转化率为____________;实验③平衡时C的浓度为____________;
(3)该反应的△H____0;其判断理由是____________________
(4)该反应进行到4.0 min时的平均反应速率:
实验②:v(B)=________________ 实验③:v(C)=___________________
(1)②改变条件:使用了催化荆,②与①最终达到的平衡状态一致,只是②达平衡所需的时间比①要短一些
③改变条件:升高温度,理由:由于反应在溶液中进行,压强对该反应的速率无影响,且达平衡时③所需的时间比①要短一些,即反应速率比①要快,且③与①平衡状态不同,只能是在①基础上升高温度
(2)40%;0.060mol/L
(3)>;由(1)中分析可知,③在①基础上升高温度,由图可知③中A转化率增大,即升高温度后,平衡正向移动,所以该反应为吸热反应,△H>0
(4)0.014 mol/(L·min);0.008mol/(L·min)
