大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为 (填“酸性”或“碱性”)溶液,其原因用离子方程式解释是: 。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有
A.CaCl2溶液 B.氨水 C.Ca(OH)2悬浊液 D.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g) + 2CO(g)  2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
①该反应平衡常数表达式K= ;温度升高K值 (填“增大”或“减小” )
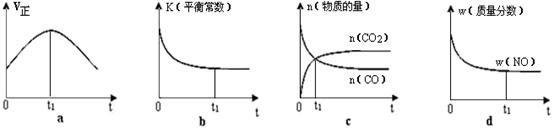
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 。
(5)使用锂离子电池为动力汽车,可减少有害气体的排放。锰酸锂离子蓄电池的反应式为:
 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池的正极应与外接电源的负极相连
(1)酸性,NH4++H2O NH3·H2O+H+ (2)B C
NH3·H2O+H+ (2)B C
(3)2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l);△H=" -955kJ/mol"
(4)①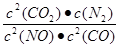 ;减小 ② D (5)C
;减小 ② D (5)C
题目分析:(1)取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则由于K+、Na+、SO42-、NO3-、Cl-都是强酸或强碱的离子,而NH4+则是弱碱根离子。含有强酸弱碱盐。弱碱根离子水解消耗水电离产生的OH-,使溶液显酸性。其原因用离子方程式解释是为NH4++H2O NH3·H2O+H+。(2)SO2溶于水发生反应:SO2+H2O=H2SO3.H2SO3是酸,电离产生大量的H+而使溶液显酸性。所以应该用碱性物质氨水、Ca(OH)2悬浊液来吸收。因此选项为B、C。(3)根据题意可得该反应的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l);△H= -955kJ/mol。(4)①根据化学平衡常数的含义可得该反应平衡常数表达式K=
NH3·H2O+H+。(2)SO2溶于水发生反应:SO2+H2O=H2SO3.H2SO3是酸,电离产生大量的H+而使溶液显酸性。所以应该用碱性物质氨水、Ca(OH)2悬浊液来吸收。因此选项为B、C。(3)根据题意可得该反应的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l);△H= -955kJ/mol。(4)①根据化学平衡常数的含义可得该反应平衡常数表达式K=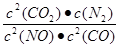 。由于该反应的正反应为放热反应。根据平衡移动原理:温度升高,化学平衡向吸热反应方向移动,对该反应来说升高温度,化学平衡向逆向移动,所以K值减小。②若该反应在绝热、恒容的密闭体系中进行。a.在反应刚开始时,由于温度变化不明显。主要是浓度的影响。随着反应的进行,气体的温度逐渐升高,影响化学反应速率的主要因素是温度。所以化学反应速率逐渐加快;当反应进行到一定程度后,反应物的浓度是影响化学反应速率的主要因素。由于反应物不断消耗,浓度减小,所以速率又逐渐减小。跟反应是否达到平衡无关。错误。B.在刚开始时反应刚发生,还未达到平衡,所以不能说平衡常数。当反应达到平衡后,升高温度,化学平衡逆向移动,K减小。但是从图像并未看出这一点来。错误。C若t点反应达到平衡,则各种反应混合物的浓度不应该发生变化。但是图像显示的c(CO)及c(CO2)任然在变化,因此反应为达到平衡。错误。d.在反应开始时,由于反应是从正反应方向开始,NO的质量最大,质量分数也最大,随着反应的减小,NO不断消耗。其质量分数也逐渐减小,当反应达到平衡后各种物质的质量、物质的量不变,所以其质量分数也不变。正确。(5)A.根据同种电荷相互排斥,异种电荷相互吸引的原则,充电时电池内部Li+向负极移动。错误。B.放电过程中,化学能转化为电能。错误。C.放电时电池正极发生还原反应。正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4。正确。D.充电时电池的正极应与外接电源的正极相连。错误。2.5样本的水溶液的酸碱性及原因、热化学方程式的书写、温度对化学平衡常数的影响、化学平衡常数的表达式、化学平衡状态的判断、电化学反应原理的知识。
。由于该反应的正反应为放热反应。根据平衡移动原理:温度升高,化学平衡向吸热反应方向移动,对该反应来说升高温度,化学平衡向逆向移动,所以K值减小。②若该反应在绝热、恒容的密闭体系中进行。a.在反应刚开始时,由于温度变化不明显。主要是浓度的影响。随着反应的进行,气体的温度逐渐升高,影响化学反应速率的主要因素是温度。所以化学反应速率逐渐加快;当反应进行到一定程度后,反应物的浓度是影响化学反应速率的主要因素。由于反应物不断消耗,浓度减小,所以速率又逐渐减小。跟反应是否达到平衡无关。错误。B.在刚开始时反应刚发生,还未达到平衡,所以不能说平衡常数。当反应达到平衡后,升高温度,化学平衡逆向移动,K减小。但是从图像并未看出这一点来。错误。C若t点反应达到平衡,则各种反应混合物的浓度不应该发生变化。但是图像显示的c(CO)及c(CO2)任然在变化,因此反应为达到平衡。错误。d.在反应开始时,由于反应是从正反应方向开始,NO的质量最大,质量分数也最大,随着反应的减小,NO不断消耗。其质量分数也逐渐减小,当反应达到平衡后各种物质的质量、物质的量不变,所以其质量分数也不变。正确。(5)A.根据同种电荷相互排斥,异种电荷相互吸引的原则,充电时电池内部Li+向负极移动。错误。B.放电过程中,化学能转化为电能。错误。C.放电时电池正极发生还原反应。正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4。正确。D.充电时电池的正极应与外接电源的正极相连。错误。2.5样本的水溶液的酸碱性及原因、热化学方程式的书写、温度对化学平衡常数的影响、化学平衡常数的表达式、化学平衡状态的判断、电化学反应原理的知识。
