[15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H (kJ/mol) | 活化能Ea (kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | 165.0 | 243.9 |
(1)反应CO(g)+H2O(g) CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;
随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
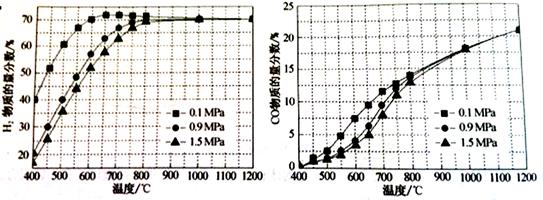
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
(15分)
(1)-41.2
(2)小于
(3)
增大
(4)系统内强放热的甲烷氧化反应为强吸热的蒸汽重整反应提供了所需的能量(其他合理答案均可)
(5)①B
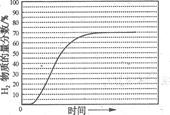
②
(6)甲烷氧化程度过高,氢气和氧气反应(其他合理答案均可)
(1)由反应CH4(g)+H2O(g) CO(g)+3H2(g) △H1="206.2" kJ/mol和CH4(g)+2H2O(g)
CO(g)+3H2(g) △H1="206.2" kJ/mol和CH4(g)+2H2O(g) CO2(g)+4H2(g) △H2="165.0" kJ/mol,再根据盖斯定律可知,反应CO(g)+H2O(g)
CO2(g)+4H2(g) △H2="165.0" kJ/mol,再根据盖斯定律可知,反应CO(g)+H2O(g) CO2(g)+H2(g)的△H=△H2-△H1="-41.2" kJ/mol;(2)开始时由于体系不能提供重整所需的热能,所以其氧化速率大于重整速率;(3)反应CH4(g)+H2O(g)
CO2(g)+H2(g)的△H=△H2-△H1="-41.2" kJ/mol;(2)开始时由于体系不能提供重整所需的热能,所以其氧化速率大于重整速率;(3)反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP=
CO(g)+3H2(g)的KP=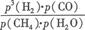 ;由于该反应为吸热反应,所以,当温度升高时其平衡常数将增大;(4)该方法的先进之处为,用甲烷氧化反应所释放出来的大量热量来满足强吸热的蒸汽重整反应所需要的热量;(5)①分析图表,从左图中可找到0.9 Mpa,700℃时H2的物质的量分数大于65%,从右图中可找到0.9 Mpa,700℃时CO的物质的量分数小于10%,所以B项正确;②图像特点为开始由于体系温度未达到400℃,重整反应微弱,H2的含量几乎为0,后随着反应进行,体系的温度升高H2的含量也增大,到接近70%时达到最大值;(6)若甲烷氧化程度过高,若氧气的含量再增加,这时氢气将和氧气反应,导致氢气的物质的量分数下降。
;由于该反应为吸热反应,所以,当温度升高时其平衡常数将增大;(4)该方法的先进之处为,用甲烷氧化反应所释放出来的大量热量来满足强吸热的蒸汽重整反应所需要的热量;(5)①分析图表,从左图中可找到0.9 Mpa,700℃时H2的物质的量分数大于65%,从右图中可找到0.9 Mpa,700℃时CO的物质的量分数小于10%,所以B项正确;②图像特点为开始由于体系温度未达到400℃,重整反应微弱,H2的含量几乎为0,后随着反应进行,体系的温度升高H2的含量也增大,到接近70%时达到最大值;(6)若甲烷氧化程度过高,若氧气的含量再增加,这时氢气将和氧气反应,导致氢气的物质的量分数下降。
【考点定位】本题考查盖斯定律、化学平衡和图表分析能力。
