问题
选择题
某绝热恒容容器中充入2mol/LNO2,发生反应2NO2 N2O4△H=—56.9kJ/mol下列分析不正确的是
N2O4△H=—56.9kJ/mol下列分析不正确的是
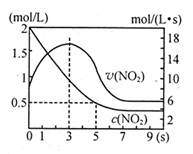
A.5s时NO2的转化率为75%
B.0—3s时v(NO2)增大是由于体系温度升高
C.3s时化学反应处于平衡状态
D.9s时再充入N2O4,平衡后K较第一次平衡时大
答案
答案:C
题目分析:A、根据图像5s时NO2的浓度为0.5mol•L‾1,则转化率为:(2mol•L‾1—0.5mol•L‾1)÷2mol•L‾1×100%=75%,正确;B、该反应为放热反应,所以0—3s时v(NO2)增大是由于体系温度升高,正确;C、NO2的浓度不变时达到平衡状态,所以3s时还未达到平衡状态,错误;D、因为该容器绝热恒容,9s时再充入N2O4,反应向左进行,吸收热量,温度降低,所以平衡常数增大,正确。
