某温度时,在密闭容器中X、Y、Z三种气体浓度的变化如图甲所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图乙所示。则下列结论正确的是
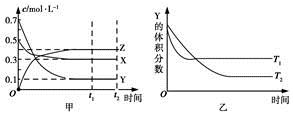
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0
2Z(g) ΔH>0
B.若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率减小
C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
答案:B
由“先拐先平数值大”结合图乙知温度:T1>T2,可见升温后Y的体积分数变大,则正反应为放热反应,再利用图甲所示各物质浓度的改变量可得反应的热化学方程式:X(g)+3Y(g)  2Z(g) ΔH<0;升温后正、逆反应速率均增大,但平衡向逆反应方向移动,使X的转化率减小;正反应是气体体积减小的反应,故达到平衡后,其他条件不变,减小容器体积平衡向正反应方向移动;达到平衡后,其他条件不变,充入稀有气体,各反应物的浓度不变,平衡不移动。
2Z(g) ΔH<0;升温后正、逆反应速率均增大,但平衡向逆反应方向移动,使X的转化率减小;正反应是气体体积减小的反应,故达到平衡后,其他条件不变,减小容器体积平衡向正反应方向移动;达到平衡后,其他条件不变,充入稀有气体,各反应物的浓度不变,平衡不移动。
