(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。
(1)已知某温度下:
反应①:CO2(g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol
反应②:  (g)→
(g)→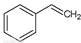 (g)+H2(g),ΔH=" +117.6" kJ/mol
(g)+H2(g),ΔH=" +117.6" kJ/mol
②的化学反应平衡常数分别为K1、K2。
请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2和2molH2,当反应达到平衡后,以下说法正确的是 。
A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小;
B.若继续加入1molCO2、1mol H2,平衡向正反应方向移动;
C.若继续通入1mol CO2则平衡向正反应方向移动,CO2的转化率增大;
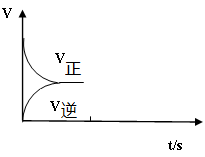
D.压缩体积,平衡不移动,反应物和产物的浓度都不变;(3)温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。
(4)已知某温度下, Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ksp(Ag2SO4)= ;(两位有效数字)
(5)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH- = FeO42-+3H2,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式) ;阳极的电极反应式为: 。
(1)CO2(g)+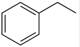 (g)→
(g)→ (g)+ H2O(g);ΔH= +158.8 kJ/mol;(3分)
(g)+ H2O(g);ΔH= +158.8 kJ/mol;(3分)
K=K1×K;(2分) (2)B(2分) (3)  (2分)
(2分)
(4)3.2×10-5 (3分) (5) Fe Fe-6e+8OH- =FeO42-+4H2O(各2分)
题目分析:(1)已知反应①:CO2(g) +H2 (g)→CO(g) + H2O(g),ΔH= +41.2 kJ/mol,反应②: 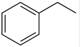 (g)→
(g)→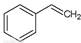 (g)+H2(g),ΔH=" +117.6" kJ/mol,则根据盖斯定律可知①+②即得到热化学方程式CO2(g)+
(g)+H2(g),ΔH=" +117.6" kJ/mol,则根据盖斯定律可知①+②即得到热化学方程式CO2(g)+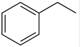 (g)→
(g)→ (g)+ H2O(g) ΔH= +158.8 kJ/mol。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则该反应的化学平衡常数
(g)+ H2O(g) ΔH= +158.8 kJ/mol。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则该反应的化学平衡常数
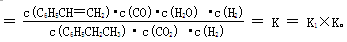
(2)A、升高温度,正反应速率增大,逆反应速率也增大,A不正确;B、温度、体积不变,若继续加入1molCO2、1mol H2,反应物浓度增大,平衡向正反应方向移动,B正确;C、若继续通入1mol CO2,反应物浓度增大平衡向正反应方向移动,但CO2的转化率减小,C不正确;D、反应前后体积不变,压缩体积,平衡不移动,但反应物和产物的浓度都增大,D不正确,答案选B。
(3)温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则反应物浓度增大,正反应速率增大,然后逐渐减小,逆反应速率逐渐增大,平衡向正反应方向进行,所以t1之后的正逆反应曲线为(见答案)。
(4)已知某温度下,Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,即100g水(溶液体积近似看做是100ml)中溶质的物质的量是0.624g÷312g/mol=0.002mol,其浓度是0.02mol/L,则根据硫酸银的电离方程式可知溶液中银离子浓度和硫酸根浓度分别是0.04mol/L、0.02mol/L,所以该温度下Ksp(Ag2SO4)=c2(Ag+)·c(SO42-)=0.042×0.02=3.2×10-5。
(5)电解池中阳极失去电子,发生氧化反应,阴极得到电子发生还原反应,则根据总反应式为:Fe+2H2O+2OH- =FeO42-+3H2可知,如果电解质溶液选用NaOH溶液。该电解池阳极材料是Fe,铁失去电子,转化为FeO42-,因此阳极的电极反应式为Fe-6e+8OH- =FeO42-+4H2O。
