.(16分)Ⅰ.已知下列反应的热化学方程式为:
(1) C(s) + O2(g) = CO2(g) △H1 =" -393.5" kJ/mol
(2) CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △H2 =" -870.3" kJ/mol
(3) 2H2(g) + O2(g) = 2H2O(l) △H3 =" -571.6" kJ/mol
请计算:2C(s) + 2H2(g) + O2(g)= CH3COOH(l) △H4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2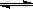 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)= 。列式计算上述反应的平衡常数K = 。
(2)有关反应:(t-BuNO)2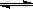 2(t-BuNO) 的叙述正确的是( )
2(t-BuNO) 的叙述正确的是( )
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
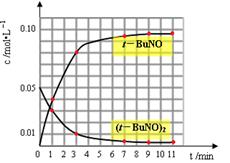
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
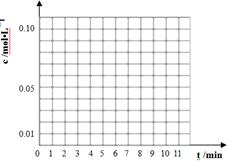
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
31.(16分)Ⅰ.-488.3kJ/mol (3分,没写单位扣1分)
Ⅱ.(1)ν(t-BuNO)=0.06mol•L-1•min-1 (2分,没写或写错单位扣1分)
解:当(t-BuNO)2的起始浓度(c0)为0.50mol•L-1时,实验测得平衡转化率(α)是60%,
则(t-BuNO)2 2(t-BuNO)
2(t-BuNO)
开始浓度(mol•L-1) 0.5 0
转化浓度(mol•L-1) 0.5×60% 0.5×60%×2 (过程1分)
平衡浓度(mol•L-1) 0.5×(1-60%) 0.5×60%×2
(或只写这个也2分) K=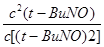 =
=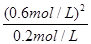 =1.8(2分)
=1.8(2分)
(2)C (2分)
(3)(2分,每条线1分,提示t-BuNO在第5min的数据
要处理掉)
Ⅲ.CH3OH + 8OH- -6 e-= CO32- + 6H2O(2分) 4(2分)
题目分析:Ⅰ.根据盖斯定律,目标方程式可由已知方程式=(1)×2+ (3) -(2),所以△H4 =2△H1+△H3-△H2 =-488.3kJ/mol。
II.(1)此题中正庚烷和CCl4均是溶剂,不参加反应,因此根据反应的方程式就可以列式计算反应的平均反应速率和平衡常数K如下:
解:当(t-BuNO)2的起始浓度(c0)为0.50mol•L-1时,实验测得平衡转化率(α)是60%,
则(t-BuNO)2 2(t-BuNO)
2(t-BuNO)
开始浓度(mol•L-1) 0.5 0
转化浓度(mol•L-1) 0.5×60% 0.5×60%×2 (过程1分)
平衡浓度(mol•L-1) 0.5×(1-60%) 0.5×60%×2
ν(t-BuNO)=△C(t-BuNO)/ △t=0.5 mol•L-1×60% ×2/10min=0.06mol•L-1•min-1
K=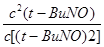 =
=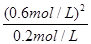 =1.8(2分)
=1.8(2分)
(2)该反应是在溶液中进行的,没有气体参加反应,因此压强不能够改变反应的平衡,A错误;该反应没有告诉焓变的大小,因此不能判断反应是吸热还是放热,因此升高温度不能确定平衡移动方向,B错误;而根据(1)中算得的相同温度下在正庚烷作溶剂的溶液中反应的K的大小为1.8,大于CCl4作溶剂时的K值1.4,因此能够说明该反应在不同溶剂的作用下,平衡常数值不同,故选C。
(3)表中给出的是不同时刻可逆反应的反应物和生成物的浓度大小,根据经验判断,随着反应的进行,反应物不断减少,生成物倍数关系增加,,各物质的量增加慢慢趋于平缓,最终达到平衡,量保持不变。因此把表中的数据全部带入时,会发现5min的点明显跟反应的趋势存在较大差异,因此该时刻的数据不能使用,应舍弃。所以作出的图像如图。
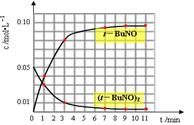
Ⅲ.甲醇做碱性燃料电池时,甲醇在负极发生失电子的反应并且和碱反应生成了CO32-,因此电极反应式为:CH3OH + 8OH- -6 e-= CO32- + 6H2O。通空气的一端为正极,氧气得到电子被还原,一个O2分子得到4个电子,因此32g氧气反应应该转移4mol电子。

 缺失,余留牙正常,行可摘局部义齿修复
缺失,余留牙正常,行可摘局部义齿修复