(17分)降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)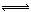 CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化如下表所示。
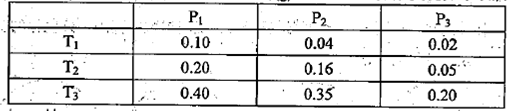
则Pl P3(填“>”“<”或“=”,下同)。若T1、Pl,T3、P3时平衡常数分别为K1、K3,
则K1 K3。T1、Pl时H2的平衡转化率为 。
②一定条件下,t上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是____ 。
A.反应物的浓度降低 B.容器内压强增大
C.正反应速率大于逆反应速率 D.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,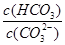 (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
A.c(K+)=2c(CO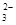 )+c(HCO
)+c(HCO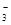 )+c(H2CO3)
)+c(H2CO3)
b.c(HCO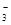 )
)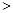 c(CO
c(CO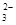 )
)
c.降低温度,c(H+)·c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为 。
(17分)
(1)① > (2分) < (2分)57.14%(2分)② c d(2分)
(2)减小(3分) b(3分)
(3)2Fe3++3CO32‾+3H2O=2Fe(OH)3(胶体)+3CO2↑(3分)
题目分析:(1)①相同温度下,P1时CH3OCH3物质的量分数大于P3时CH3OCH3物质的量分数,根据化学方程式,加压平衡向右移动,所以P1 >P3;T3时CH3OCH3物质的量分数大于T1时CH3OCH3物质的量分数,因为该反应为放热反应,升高温度,平衡向逆反应方向移动,所以K1<K3;根据“三段式”进行计算,设生成的CH3OCH3的物质的量为x,则
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
起始物质的量(mol) 2 6 0 0
转化物质的量(mol) 2x 6x x 3x
平衡物质的量(mol) 2— 2x 6—6x x 3x
则x/(8-4x)=0.1,解得x=0.5714,H2的平衡转化率=6x/6×100% =57.14%
②a、生成物的浓度也可能降低,如增大体积,平衡向逆反应方向移动,错误;b、如果加入惰性气体使容器内压强增大,平衡不移动,错误;c、正反应速率大于逆反应速率,平衡一定向正反应方向移动,正确;d、化学平衡常数K增大,说明平衡一定向正反应方向移动,正确。
(2)碳酸氢钾溶液加水稀释,HCO3‾的电离平衡向右移动,所以c(HCO3‾)/c(CO32‾)减小;因为K2CO3和KHCO3溶液呈碱性,所以当溶渡呈中性时,CO2过量,溶液的溶质为KHCO3和H2CO3,故b项正确,根据电荷守恒可得c(K+)=2c(CO )+c(HCO
)+c(HCO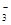 ),故a项错误,降低温度,水的电离平衡向左移动,c(H+)·c(OH-)减小,c项错误。
),故a项错误,降低温度,水的电离平衡向左移动,c(H+)·c(OH-)减小,c项错误。
(3)产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,说明生成了CO2气体和Fe(OH)3胶体,所以离子方程式为:2Fe3++3CO32‾+3H2O=2Fe(OH)3(胶体)+3CO2↑。

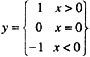 以下程序段中不能根据x值正确计算出y值的是
以下程序段中不能根据x值正确计算出y值的是