问题
计算题
已知化学方程式
7Cl2+14NaOH 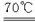 9NaCl+4NaClO+NaClO3+7H2O
9NaCl+4NaClO+NaClO3+7H2O
试求在该反应中:
(1)被氧化与被还原的氯原子数之比为多少?
(2)当有49.7% g Cl2参与反应时,氧化产物的质量为多少克?
答案
(1)5∶9 (2)40.5 g。
(1)7 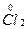 +14NaOH
+14NaOH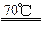 9Na
9Na  +4Na
+4Na 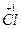 O+Na
O+Na  O3+7H2O
O3+7H2O
9个原子的化合价由0价变为-1价,化合价降低,被还原。4个Cl化合价由0价变为+1价,1个Cl化合价由0价变为+5价,5个Cl化合价升高,被氧化。
N被氧化(Cl)∶N被还原(Cl)=5∶9(化学上用“N”表示粒子个数)。
(2)(和量法):氧化产物为NaClO和NaClO3
7 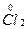 +14NaOH
+14NaOH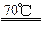
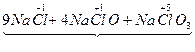 +7H2O
+7H2O
7×71.0 404.5
49.7g m(氧化产物)
m(氧化产物)="40.5" g。
