(14分)
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)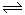 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 | 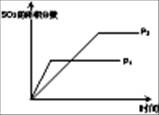 |  |  |  |
乙。(填“>”“<”或“="”" )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
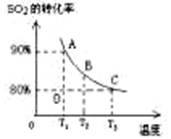
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“="”" )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
(每空2分,共14分)
(1) C (有错计0分)
(2) <
(3) I > II B C(对一个计1分,有错计0分)
(4) 90%
(5) c (Na+) >c (HSO3—) >c (H+)>c (SO32—)>c (OH—) (有错计0分 )
(6)1/6 ×10-2 或1.67 ×10-3
题目分析:(1)A、由图可知,P1>P2,压强增大,平衡正向移动,三氧化硫的体积分数应增大,与图不符,错误;B、该反应为放热反应,温度升高,平衡逆向移动,二氧化硫的转化率降低,与图不符,错误;C、增加氧气得浓度,正反应速率增大,逆反应速率不变,平衡正向移动,与图符合,正确;D、氧气浓度增大,但温度不变,平衡常数不变,与图不符,错误,答案选C。
(2)开始时甲、乙两容器的压强相同,达平衡时,甲容器的压强小于乙,所以甲容器需增大压强才能达到乙容器的压强,而增大压强,平衡正向移动,三氧化硫的体积分数增大,所以SO3的体积分数甲<乙;
(3)I、T1温度时A点代表此温度的二氧化硫平衡转化率,D点的二氧化硫的转化率低于A点,说明反应未达平衡,所以v正>v逆;
II、恒温恒容时再向甲容器中通入2molSO2、1molO2,反应物浓度是原来的2倍,在原平衡的基础上,平衡正向移动,正向是气体压强减小的方向,所以达新平衡时压强大于原平衡时的压强但小于两倍原平衡的压强,放出的热量比Q1多,二氧化硫的转化率提高,所以答案选BC;
(4)设充入二氧化硫的物质的量为amol,每消耗2mol 二氧化硫,气体的总物质的量减少1mol,现在气体的物质的量减少0.315mol,说明消耗二氧化硫0.63mol,消耗氧气0.315mol,生成三氧化硫0.63mol,根据恒温下压强之比等于气体物质的量之比,有(a-0.63+0.63+1.1-0.315)/(a+1.1)=82.5%,解得a=0.7,所以SO2的转化率为0.63mol/0.7mol×100%=90%;
(5)二氧化硫与氢氧化钠反应得酸式盐为亚硫酸氢钠,溶液呈酸性,说明HSO3—的电离程度大于水解程度,溶液中离子浓度的大小顺序为 c (Na+) >c (HSO3—) >c (H+)>c (SO32—)>c (OH—)
(6)溶液中的c (H+)=1×10-5mol/L,平衡时Ka2=6.0×10-3mol/L=c (SO32—)c (H+)/c (HSO3—),所以c (HSO3—)/c (SO32—)="c" (H+)/Ka2=1/6 ×10-2。
