(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2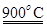 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是 ,该反应将太阳能转化为 。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O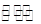 HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
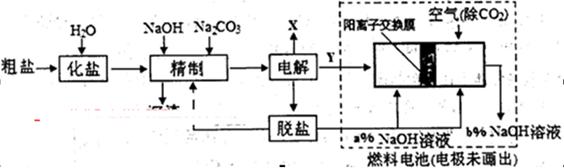
①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为 。
(18分)
(1)H2O + CO2 =H2 + CO + O2(2分) 化学能(1分)
(2)CO – 2e- +4OH- = CO32- + 2H2O(2分) 2×10-4 mol·L-1(2分)
(3)①2Cl-+2H2O  Cl2↑+ H2↑+2OH-(2分) 升高(1分)
Cl2↑+ H2↑+2OH-(2分) 升高(1分)
② ac(2分) BaCO3(s)+ SO42-(aq) = BaSO4 (s)+ CO32-(aq)(2分)
③ <(2分) H2-2e-+2OH-=2H2O (2分)
题目分析:(1)两式相加可得总反应方程式:H2O + CO2 =H2 + CO + O2;通过该反应把太阳能转化为了化学能。
(2)在碱性条件下,CO失电子转化为CO32‾,电解方程式为:CO – 2e- +4OH- = CO32- + 2H2O;溶液的pH=12,则c(OH‾)=0.01mol•L‾1,若忽略CO32-的第二级水解,c(HCO3‾)=0.01mol•L‾1,则Kh=c(HCO3‾)•c(OH‾)/c(CO32‾)= 0.01mol•L‾1×0.01mol•L‾1/0.5mol•L‾1= 2×10-4 mol·L-1。
(3)①电解食盐水生成H2、H2和NaOH,所以离子方程式为:2Cl-+2H2O  Cl2↑+ H2↑+2OH-;阴极上H2O电离出的H+得电子生成H2,使H2O的电离平衡向右移动,OH‾浓度增大,所以pH升高。
Cl2↑+ H2↑+2OH-;阴极上H2O电离出的H+得电子生成H2,使H2O的电离平衡向右移动,OH‾浓度增大,所以pH升高。
②Ba(OH)2可与SO42‾反应,OH‾可加盐酸除去,BaCl2可与SO42‾反应,而且不引入新杂质,Ba(NO3)2能与SO42‾反应,但NO3‾无法除去,故ac正确;BaCO3转化为更难溶的BaSO4,离子方程式为:BaCO3(s)+ SO42-(aq) = BaSO4 (s)+ CO32-(aq)。
③在燃料电池中,氧气作正极,所以通入空气的极是正极,O2得电子生成OH‾,通入燃料的电极是负极,消耗OH‾,所以a% < b%;负极是燃料氢气发生失电子的氧化反应,电极反应式为H2-2e-+2OH-=2H2O。
