碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活.
已知:
①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式______.
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池.其负极电极反应式是:______.
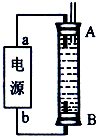
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是______(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)
CO2(g)+H2(g),得到如下三组数据:高温
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验3跟实验2相比,改变的条件可能是______(答一种情况即可).
(1)由①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
根据盖斯定律,由
可得甲烷燃烧热的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ.mol-1,①+② 2
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ.mol-1;
(2)甲烷碱性燃料电池中,甲烷为负极,失去电子发生氧化反应,负极反应为CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4-8e-+10OH-═CO32-+7H2O;
(3)通电后,溶液中产生大量的白色沉淀,且较长时间不变色,由图可知B应为阳极,且B为Fe电极,A为阴极,氢离子放电,
A.电源中的a与A相连,则a为负极,b与B相连,则b为正极,故A错误;
B.可以用NaCl溶液作为电解液,阴极氢离子放电生成碱,故B正确;
C.A的电极材料任选,而B电极一定为Fe,故C错误;
D.阴极氢离子放电,其电极反应为2H++2e-=H2↑,故D正确;
故答案为:BD;
(4)①利由表格中的数据可知,v (CO)=
=0.16mol/(L?min),由反应速率之比等于化学计量数之比,则v (H2)=0.16mol/(L?min),1.6mol 2L 5min
故答案为:0.16mol/(L?min);
②实验3跟实验2相比,起始温度、浓度均相同,且平衡浓度相同,但实验3的反应速率大,则可能使用了催化剂或增大了压强等,
故答案为:使用了催化剂(或加大了压强).
