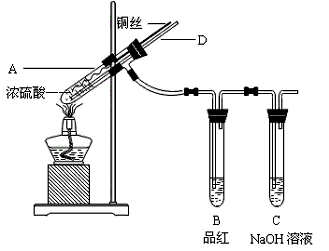
下列叙述中正确的是[ ]
A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: △H=-38.6kJ/mol
△H=-38.6kJ/mol
B.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
BC