饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3-的浓度,某兴趣小组提出如下方案:
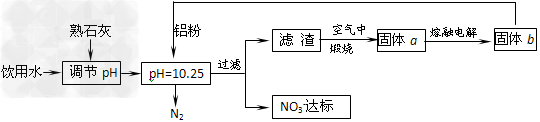
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为__________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成____________的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________。
⑷饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
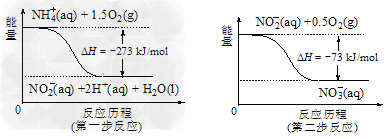
试写出1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____________________。
⑴10Al+6NO3-+18H2O==10Al(OH)3+3N2↑+6OH-
⑵引入的Ca2+对人体无害;来源丰富、价格便宜;铝
⑶5H2+2NO3- ==N2+4H2O+2OH-
⑷NH4+(aq)+2O2(g)==2H+(aq)+NO3-(aq)+H2O(l) △H =-346 kJ/mol
