问题
问答题
依据事实,写出下列反应的热化学方程式.
(1)1molC与1mol水蒸气反应生成1mol CO和1mol H2,吸收131.5kJ的热量______
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______.
答案
(1)1molC与1mol水蒸气反应生成1mol CO和1mol H2,吸收131.5kJ的热量,则热化学方程式为:C (S)+H2O (g)

CO (g)+H2 (g)△H=+131.5kJ•mol-1,
故答案为:C (S)+H2O (g)

CO (g)+H2 (g)△H=+131.5kJ•mol-1;
(2)在反应N2+3H2⇌2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,故答案为:N2(g)+3H2(g)
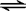
2NH3(g)△H=-92kJ•mol-1.
