20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态.
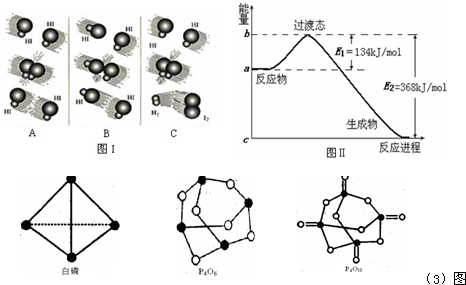
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是______(选填“A”、“B”或“C”);
(2)图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______;
(3)下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 198 | 360 | 498 | X |
(4)0.5mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为______kJ.
(1)发生化学反应的碰撞才是有效碰撞,根据图可知只有C发生化学变化,则C发生有效碰撞,故答案为:C;
(2)反应物总能量大于生成物总能量,反应放热,反应热等于134kJ/mol-368kJ/mol=-234kJ/mol,
则热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g);△H=-234 kJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=-234 kJ/mol;
(3)白磷燃烧的热化学方程式为P4(s)+5O2(g)=P4O10(s)△H=-2982kJ/mol,
则6×198kkJ/mol+5×498kJ/mol-12×360kJ/mol-4X=-2982kJ/mol,
X=585kJ/mol,
故答案为:585;
(4)白磷燃烧生成P4O6的热化学方程式为P4(s)+3O2(g)=P4O6(s);
△H=6×198kkJ/mol+3×498kJ/mol-12×360kJ/mol=-1638kJ/mol,
则0.5mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为0.5mol×1638kJ/mol=819kJ,
故答案为:819.
