无水AlCl3可用作有机合成的催化剂、食品膨松剂等.工业制备无水AlCl3的流程如下:

(1)已知:C(s)+
O2(g)═CO(g)△H=-110.5kJ/mol,2Fe(s)+1 2
O2(g)═Fe2O3(s)△H=-822.1kJ/mol3 2
请写出C还原Fe2O3生成CO的热化学方程式______.
(2)反应2CO+O2
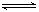
2CO2的平衡常数为K1;反应4Fe+3O2

2Fe2O3的平衡常数K2,则反应3CO+Fe2O3

2Fe+3CO2的平衡常数K与K1、K2的关系式______.
(3)高温下,氧化铁能跟碳发生下列反应:
①Fe2O3+3C
2Fe+3CO ②Fe2O3+3CO 高温 .
2Fe+3CO2若反应产生的气体是CO2和CO,则 高温 .
的取值范围是______.n(C) n(Fe2O3)
(4)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因______.
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)

2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是______(填序号):
①增加C的量 ②多通入Cl2③升高温度 ④移走部分AlCl3(g) ⑤使用合适的催化剂工业上还常采用向氯化炉中通入O2的方法,其目的是______.
(6)沉淀分析法一般规定:溶液中某离子物质的量浓度低于1.0×10-5mol/L时,可认为已沉淀完全.现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2mol/L.此时所得沉淀中______(填“是”或“否”)含有Al(OH)3.(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33).
(1)C还原Fe2O3生成CO的热化学方程式:3C(s)+Fe2O3(s)═3CO(g)+2Fe(s);△H
由盖斯定律,将第一个将第一个热化学方程式乘以3,减去第二个热化学方程式,即得该热化学方程式,
反应热△H=3×(-110.5kJ/mol)-(-822.1kJ/mol)=+490.6kJ/mol;
所以C还原Fe2O3生成CO的热化学方程式为:3C(s)+Fe2O3(s)═3CO(g)+2Fe(s)△H=+490.6kJ/mol;
(2)反应2CO+O2
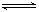
2CO2的平衡常数为K1=
,c2(CO2) c2(CO)•c(O2)
反应4Fe+3O2
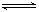
2Fe2O3的平衡常数K2=
,c2(Fe2O3) c4(Fe) •c3(O2)
反应3CO+Fe2O3
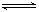
2Fe+3CO2的平衡常数K=
=c3(CO2)•c2(Fe) c3(CO)•c(Fe2O3)
;K 31 K2
(3)假设产生的气体全为CO,由化学方程式Fe2O3+3C
2Fe+3CO↑,可知 高温 .
=3,n(C) n(Fe2O3)
假设产生的气体全为CO2,由方程式①+②,可得方程式:2Fe2O3+3C
4Fe+3CO2↑,则 高温 .
=1.5,n(C) n(Fe2O3)
所以若反应产生的气体是CO2和CO,1.5<
<3;n(C) n(Fe2O3)
(4)亚硫酸钠为弱酸强碱盐,在溶液中发生水解,离子方程式为SO32-+H2O
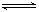
HSO3-+OH-,水的电离平衡向右移动,直至建立新的平衡,溶液中c(OH-)>c(H+),溶液呈碱性;
(5)氯化炉中发生:3Cl2(g)+3C(s)+Al2O3(s)
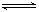
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,需要是平衡向正反应方向移动,
①增加固体和纯液体的量不能改变其浓度也不能改变速率,平衡不移动,故①错误;
②多通入氯气,使反应物的浓度增加,正反应速率增大,平衡向正反应方向移动,故②正确;
③正反应为吸热反应,升高温度,是平衡向正反应方向移动,故③正确;
④移走部分氯化铝,是逆反应速率降低,平衡向正反应方向移动,故④正确;
⑤加入催化剂对正反应速率和逆反应速率的影响是等同的,平衡不移动,故⑤错误;
故选①⑤;
向氯化炉中通入O2可以与碳或生成的一氧化碳反应,提供反应所需的热量;
(6)当Fe3+完全沉淀时,c(Fe3+)=1.0×10-5,c(OH-)=
,3 1.4×10-38 1.0×10-5
此时Al3+和OH-的浓度商c(Al3+)×c3(OH-)=0.2mol/L×(
)3=0.7×10-33mol/L<1.1×10-33;3 1.4×10-38 1.0×10-5
所以没有Al(OH)3沉淀;
(1)3C(s)+Fe2O3(s)═3CO(g)+2Fe(s)△H=+490.6kJ/mol,
(2)
;K 31 K2
(3)1.5<
<3;n(C) n(Fe2O3)
(4)SO32-+H2O
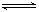
HSO3-+OH-;
(5)①⑤;与C或CO反应,提供反应所需的热量;
(6)否.




 请根据以上资料,选择以下栏目正确选项:
请根据以上资料,选择以下栏目正确选项: