在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量.
(1)写出肼和过氧化氢的结构式 肼______,过氧化氢______.
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是______.
(3)写出肼和双氧水反应的热化学方程式______.
(4)已知H2O(l)═H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是______.
(5)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.已知:
N2 (g)+2O2(g)=2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ/mol
H2 (g)+F2(g)=HF (g)△H=-538kJ/mol
2H2 (g)+O2 (g)=2H2O (g)△H=-484kJ/mol
则肼与NO2完全反应的热化学方程式为______.有人认为若用F2 (g)代替二氧化氮作氧化剂,则反应释放能量更大,N2H4 (g)和F2 (g)反应的热化学方程式:______.
(1)N2H4中N原子之间形成1对共用电子对,N原子H原子质量形成1对共用电子对,结构式为
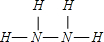
;
H2O2中O原子之间形成1对共用电子对,O原子与H原子之间形成1对共用电子对,结构式为H-O-O-H,
故答案为:
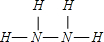
;H-O-O-H;
(2)肼(N2H4)和H2O2反应,产物为氮气和水,无污染,故答案为:产物为氮气和水,无污染;
(3)0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量,1mol液态肼放出的热量为256.65kJ×
=641.625kJ,1mol 0.4mol
该反应热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
(4)已知:①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,
②H2O(l)═H2O(g)△H=+44KJ/mol,
根据盖斯定律,①-②×4得N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.625kJ/mol,
16g液态肼的物质的量为
=0.5mol,完全反应生成液态水时放出的热量为0.5mol×817.625kJ/mol=408.8k,J16g 32g/mol
故答案为:408.8kJ;
(5)已知:Ⅰ、N2 (g)+2O2(g)=2NO2 (g)△H=+67.7kJ/mol
Ⅱ、N2H4(g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ/mol
根据盖斯定律,Ⅱ×2-Ⅰ得2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1153.7KJ/mol,
已知:Ⅰ、N2H4(g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ/mol
Ⅱ、H2 (g)+F2(g)=2HF (g)△H=-538kJ/mol
Ⅲ、2H2 (g)+O2 (g)=2H2O (g)△H=-484kJ/mol
根据盖斯定律,Ⅰ-Ⅲ+Ⅱ×2得N2H4(g)+2F2 (g)═N2(g)+4HF (g)△H=-1135KJ/mol;
故答案为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1153.7KJ/mol;
N2H4(g)+2F2 (g)═N2(g)+4HF (g)△H=-1135KJ/mol.
