2007年10月24日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥一号”探月卫星成功送入太空,迈出了向广寒宫求索的第一步.“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,第三级为液态氧燃料.
(1)常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂.但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体).
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ•mol-1
H2(g)+1 2
F2(g)=HF(g);△H=-269kJ•mol-11 2
H2(g)+
O2(g)=H2O(g);△H=-242kJ•mol-11 2
请写出肼和氟气反应的热化学方程式:______;
(2)氢是一种理想的绿色能源,最近科学家利用太阳光分解水来制备氢.如图为光分解水制氢的循环系统,反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用.
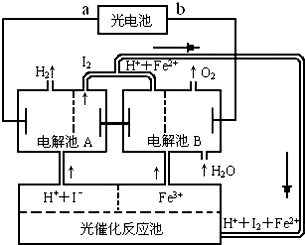
①判断光电池的a端为______极,b端为______极;
②写出电解池A中电极反应式:
阴极______,阳极______;
③电解池B中反应的离子方程式______;
④若电解池A中生成H2的体积为8.96L(标准状况下),则电解池B中生成Fe2+的物质的量为______.
(1)由N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ•mol-1①
H2(g)+1 2
F2(g)=HF(g);△H=-269kJ•mol-1②1 2
H2(g)+
O2(g)=H2O(g);△H=-242kJ•mol-1③1 2
利用盖斯定律可知①+②×4-③×2可得反应N2H4(g)+2F2(g)=N2(g)+4HF(g),
该反应的△H=(-543kJ•mol-1)+4×(-269kJ•mol-1)-2×(-242kJ•mol-1)=-1135kJ•mol-1,
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135kJ•mol-1
(2)电解池左边放出氢气,氢离子在此得到电子,故左侧为电解池阳极,所以a端为原电池负极,b端为正极碘离子在此失去电子.
故答案为:①负,正
②2H++2e-→H2↑,2I-→I2+2e-
③4Fe3++2H2O
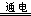
O2↑+4H++4Fe2+
(4)据原电池原理,得失电子守恒有n(H2)=V/Vm=8.96L/22.4molL-1=0.4mol,所以 故答案为:失去电子数为2×0.4mol=0.8mol,Fe3+→Fe2+,得到电子数为2×0.4mol
故答案为:0.8mol
