(1)在25℃、101kPa状况下,4g氢气和适量氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______.
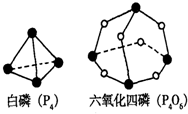
(2)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构,如图所示;现提供以下化学键的键能:P-P 198KJ•mol-1,P-O 360kJ•mol-1氧气分子内氧原子间的键能为498kJ•mol-1则P4+3O2=P4O6的△H为______;
(3)下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属 质量/g | 金属 状态 | C(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
①实验4和5表明,______对反应速率有影响,能表明同一规律的实验还有______(填实验序号);
②仅表明反应物浓度对反应速率产生影响的实验有______(填实验序号);
③本实验中除上述中所列的因素外,影响反应速率的其他因素还有______,其实验序号是______.
(1)生成1mol水蒸气放热241.8kJ,在反应2H2(g)+O2(g)═2H2O(g)中,
生成2molHCl放出2×241.8kJ=483.6kJ,则热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,
故答案为:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol;
(2)各化学键键能为P-P 198kJ•mol-1、P-O 360kJ•mol-1、O=O 498 kJ•mol-1.
反应热△H=反应物总键能-生成物总键能,
所以反应P4+3O2=P4O6的反应热△H=6×198kJ•mol-1+3×498kJ•mol-1-12×360kJ•mol-1=-1638kJ•mol-1,
故答案为:-1638kJ•mol-1;
(3)①对比实验4和5,反应物的浓度和实验温度相同,但固体的不同,粉末状金属反应速率达,探究的是表面积对反应速率的影响,其中1和2实验能表明同一规律,
故答案为:固体表面积;1和2;
②2和5实验,固体变面积相同,温度相同,但反应物的浓度不同,二者探究的而是浓度对反应速率的影响,
故答案为:2和5;
③6和7实验固体的表面积相同,反应物的浓度不同,但反应的温度不同,探究的是温度对反应速率的影响,
故答案为:温度;6和7.
